导读聚焦
本期绘谱导读聚焦于8篇近期发表的肠道微生物-宿主代谢互作的顶刊论文:
①解锁胆汁酸互作的健康网络:肠道微生物与胆汁酸存在双向调控网络,结合BXD遗传参考群体的研究,解析基因背景与饮食如何共同塑造微生物 - 胆汁酸互作,揭示次级胆汁酸在西方饮食相关结直肠癌中的关键作用。
②从炎症到癌变的 “隐秘免疫炎症推手”:重点解析特定肠道菌株(如P. excrementihominis)通过致病性NETosis激活炎症、驱动结直肠癌的机制,同时梳理菌群氨基酸代谢产物调控CD8⁺T细胞功能、影响肿瘤免疫的前沿发现。
③吲哚类代谢“双生花”:吲哚-3-丙酸&吲哚-3-乙酸可分别从重塑骨髓造血和抑制结直肠癌细胞增殖、肿瘤生长及肝转移。
④肠道菌群的整体功能出新:肠道微生物组预测糖尿病前期个体对膳食纤维干预的响应,口服微生物群疗法攻克复发性艰难梭菌感染。
导读目录
-
Nature Communication | BXD遗传参考群体中肠道微生物组-胆汁酸互作的遗传与饮食决定因素
-
Nature Medicine | VOS口服微生物群疗法破解复发性艰难梭菌感染长效复发
-
Gut | P. excrementihominis通过致病性NETosis激活加剧实验性结肠炎及结肠炎相关结直肠癌
-
Gut | 肠道细菌产生的次级胆汁酸促进西方饮食相关的结直肠癌发生
-
Nature Comunications | 化疗诱导的肠道菌群失调与吲哚-3-丙酸重塑骨髓造血,促进抗转移状态
-
Nature Comunications | 肠道微生物组预测糖尿病前期个体对膳食纤维干预的个性化反应
-
Cell Host & Microbe | 肠道微生物氨基酸代谢通过调控CD8⁺T细胞功能影响癌症进展及抗肿瘤免疫力
-
Advanced Science | 结直肠癌细胞的武器:RNF32与SPP1+巨噬细胞结合以促进肝脏转移,以吲哚-3-乙酸为靶点
资源领取
本期导读文献原文,请在公众号后台回复“2026年1月绘谱导读”,即可获取资源链接。
#1
Nature Communication | BXD遗传参考群体中肠道微生物组-胆汁酸互作的遗传与饮食决定因素

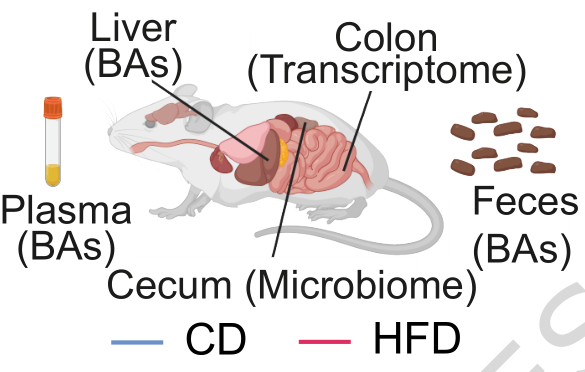
肠道微生物群在整体生理调节中起着关键作用,并通过多种微生物衍生的代谢物(如次级胆汁酸)与宿主相互作用。然而,肠道微生物群与胆汁酸之间的相互作用机制(gMxB)仍不清楚。本研究系统分析了喂食普通饲料或高脂肪饲料的雄性BXD小鼠的盲肠微生物群、胆汁酸水平以及结肠转录组,发现遗传和饮食因素共同改变微生物群组成并影响gMxB。通过系统遗传学方法,进一步鉴定出4个与gMxB相关的饮食依赖性共定位遗传位点。通过整合人类MiBioGen数据库,筛选出PTGR1与PTPRD作为调控上述互作的潜在宿主基因,为深入理解肠道微生物与宿主的分子交流机制提供了新的见解。
1、通过微生物组分析发现,高脂饮食显著降低了菌群的α多样性,并鉴定出15个差异丰度菌属,其中Lactococcus丰度明显升高、Turicibacter明显降低,且Firmicutes/Bacteroidota比值呈品系特异性变化。
2、通过靶向胆汁酸检测以及关联分析发现,普通饲料条件下,香农指数(菌群多样性)与粪便、肝脏和血浆中的次级胆汁酸/初级胆汁酸(secondary BA/primary BA)比值呈正相关。而在高脂饮食喂养后这些相关性便消失了,高脂饮食破坏了微生物群与胆汁酸代谢的相互作用。
3、通过转录组分析发现,高脂饮食诱导炎症相关基因(Saa1、Saa3)上调,抑癌基因(Cyp2c55)及肠道保护基因(Ces2a)下调。进一步通过稀疏典型相关分析发现,高脂饮食特异性地诱导了肠道菌群与宿主炎症、免疫相关基因通路(如干扰素反应、白细胞介素信号)的关联。
4、进一步鉴定出4个与菌群-胆汁酸互作相关的共定位遗传位点:gMxB1调控正常饮食下Turicibacter sanguinis的丰度与血浆/肝脏中的胆酸、鹅去氧胆酸水平。gMxB2调控正常饮食下 T. sanguinis 的丰度与肝脏胆酸水平。gMxB3调控高脂饮食下Bacteroides uniformis的丰度与粪便中的α-MCA、TLCA、UDCA水平。gMxB4调控高脂饮食下Bacteroides属的丰度与粪便中的7-酮基-LCA和DCA水平。
参考文献:Li X, Perino A, Sulc J, et al. Genetic and dietary determinants of gut microbiome-bile acid interactions in the BXD genetic reference population. Nature Communications. 2025
#2
Nature Medicine | VOS口服微生物群疗法破解复发性艰难梭菌感染长效复发

艰难梭菌感染所引发的严重腹泻是由细菌毒素的产生导致的,尽管使用抗生素是当前的标准治疗手段,仍有20%-30%的患者会出现反复感染,仅依靠抗生素治疗复发型艰难梭菌感染(rCDI)复发率高,还存在住院和死亡风险。该研究通过对VOS(原 SER-109)的三项临床试验数据进行分析,发现VOS显著改变了患者肠道微生物组成,显著增加了厚壁菌门物种,并降低了艰难梭菌及机会致病菌丰度,同时调节胆汁酸和脂肪酸代谢产物,为rCDI的临床治疗提供了新的理论依据和治疗策略。
1、通过临床试验分析发现,在III期高剂量试验中,VOS治疗组8周复发率仅12%,显著低于安慰剂组(40%)。
2、通过微生物组分析发现,III期高剂量VOS的植入率显著高于安慰剂组,VOS组厚壁菌门丰度显著升高,变形菌门丰度显著降低,且艰难梭菌及条件致病菌的丰度也显著低于安慰剂组。
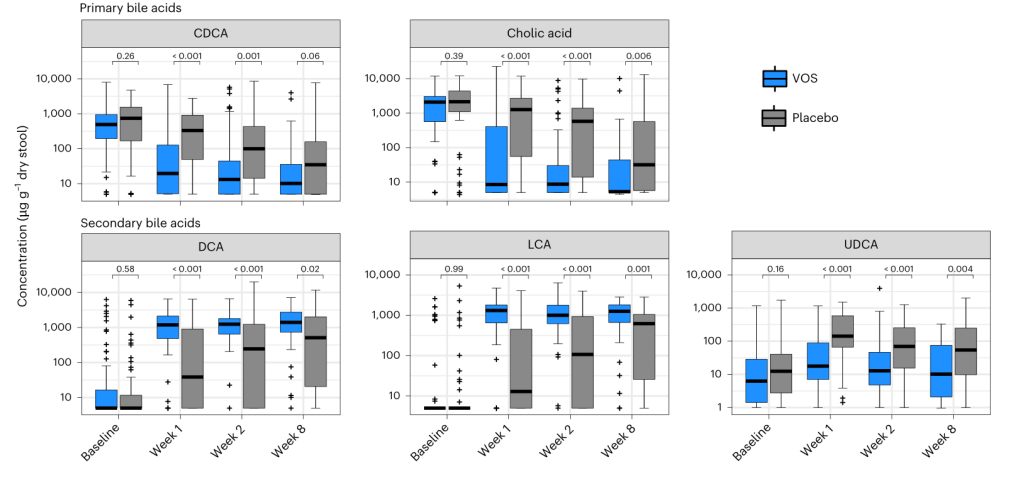
3、通过靶向胆汁酸检测发现,VOS 治疗后,初级胆汁酸(胆酸、鹅去氧胆酸)浓度显著降低,次级胆汁酸(脱氧胆酸、石胆酸)浓度显著升高。进一步通过脂肪酸检测发现,VOS显著提高了短链及中链脂肪酸(如丁酸、戊酸和己酸)的水平。
4、体外实验进一步证实丁酸、戊酸和己酸能抑制艰难梭菌生长,且抑制效果随碳链长度增加而增强。
参考文献:Bryant JA, Vulić M, Walsh EA, et al. The impact of an oral purified microbiome therapeutic on the gastrointestinal microbiome. Nature Medicine. 2026
#3
Gut | P. excrementihominis通过致病性NETosis激活加剧实验性结肠炎及结肠炎相关结直肠癌

肠道菌群失调是溃疡性结肠炎(UC)及结肠炎相关结直肠癌(CAC)发生发展的重要驱动因素,然而关键致病菌及其具体作用机制尚未完全阐明。本研究发现,一种在UC患者中显著富集的β-变形菌纲细菌——Parasutterella excrementihominis(P. excrementihominis)可通过其代谢产物琥珀酸(Suc)和6-羟基己酸(6-HHA)激活中性粒细胞胞外诱捕网(NETs)的形成,从而加剧结肠慢性炎症并促进肿瘤发生。该研究揭示了细菌代谢产物在炎症相关结直肠癌中的作用机制。
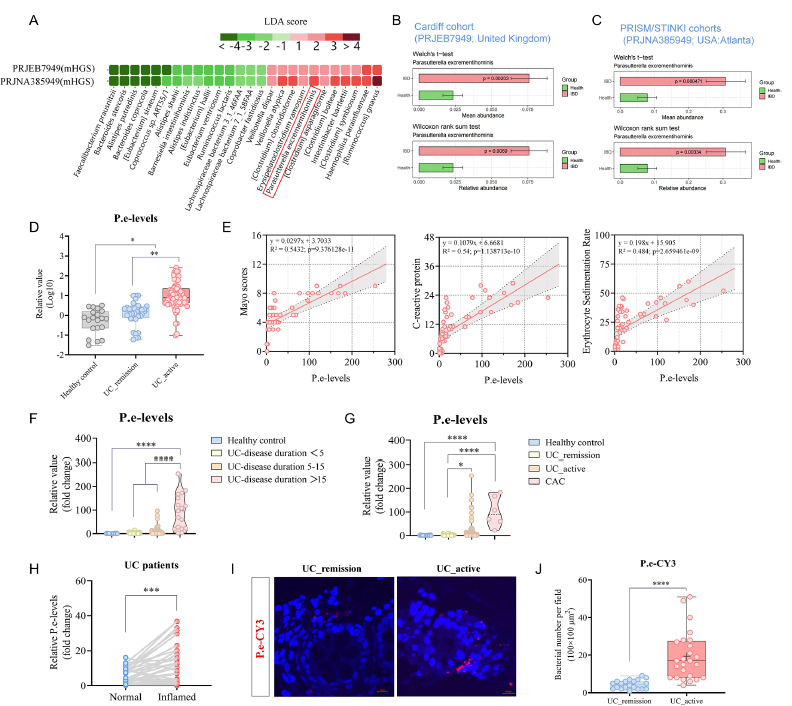
1、首先,通过对GMrepo数据库的分析以及115例UC患者粪便样本的qPCR检测,发现P. excrementihominis在活动期UC患者中的丰度显著升高,且其水平与Mayo评分呈正相关。在DSS诱导的小鼠结肠炎模型中进一步验证,仅活菌及其培养上清能够加重结肠炎症并促进中性粒细胞浸润;利用Ly6G中和抗体耗竭中性粒细胞或采用PADI4基因敲除小鼠进行实验,表明该菌主要通过激活NETosis途径加剧肠道炎症。
2、其次,通过多组学技术阐明P. excrementihominis的代谢调控机制。对无菌小鼠进行单菌定植后,利用RNA测序和非靶向代谢组学分析发现,该菌显著增强宿主的碳水化合物代谢能力,导致其特异性代谢产物琥珀酸(Suc)和6-羟基己酸(6-HHA)在粪便、血清及细菌上清中显著积累。体外实验证实,这两种代谢物能够选择性激活经LPS预刺激的中性粒细胞,上调NETs相关基因表达,并通过分子对接验证其与GPR84/SUCNR1受体的结合,进而促进NLRP3炎症小体活化及GSDMD切割,最终驱动NETs形成。
3、进一步地,在AOM/DSS诱导的CAC模型中,灌胃P. excrementihominis或直接补充Suc与6-HHA均显著增加结肠肿瘤负荷并上调NETs标志物表达;而在中性粒细胞特异性GSDMD缺失小鼠中,上述促肿瘤效应明显减弱,证实GSDMD依赖性NETosis在代谢物驱动的肿瘤进展中发挥关键作用。
4、最后,通过衰老模型与饮食干预实验,揭示了环境因素对P. excrementihominis定植及其致病性的调控作用。通过对老年与年轻小鼠进行16S rRNA测序分析,发现老年小鼠肠道中P. excrementihominis丰度显著升高;进一步的粪菌移植实验证实,老年供体菌群可加速年轻受体小鼠的CAC发展。饮食干预实验发现,高碳水化合物饮食促进P. excrementihominis的定植与扩张,而生酮饮食则能有效抑制其生长,为通过膳食策略靶向该致病菌提供了实验依据。
参考文献:Tan H, Huang L, Wang J, et al.Parasutterella excrementihominis exacerbates experimental colitis and colitis-associated colorectal cancer via pathogenic NETosis activation. Gut. 2025
#4
Gut | 肠道细菌产生的次级胆汁酸促进西方饮食相关的结直肠癌发生

肠道微生物群在西方饮食相关的结直肠癌(CRC)发生发展中具有重要作用,但特定菌群及其代谢产物在其中的因果机制仍不明确。本研究通过多物种模型和干预实验证实,肠道细菌经7α-脱羟基化(7αDH)产生的次级胆汁酸尤其是脱氧胆(DCA)是西方饮食促进CRC的关键介质,揭示了从饮食、微生物代谢到肿瘤发生的因果链条,为基于菌群干预的CRC预防提供了新思路。
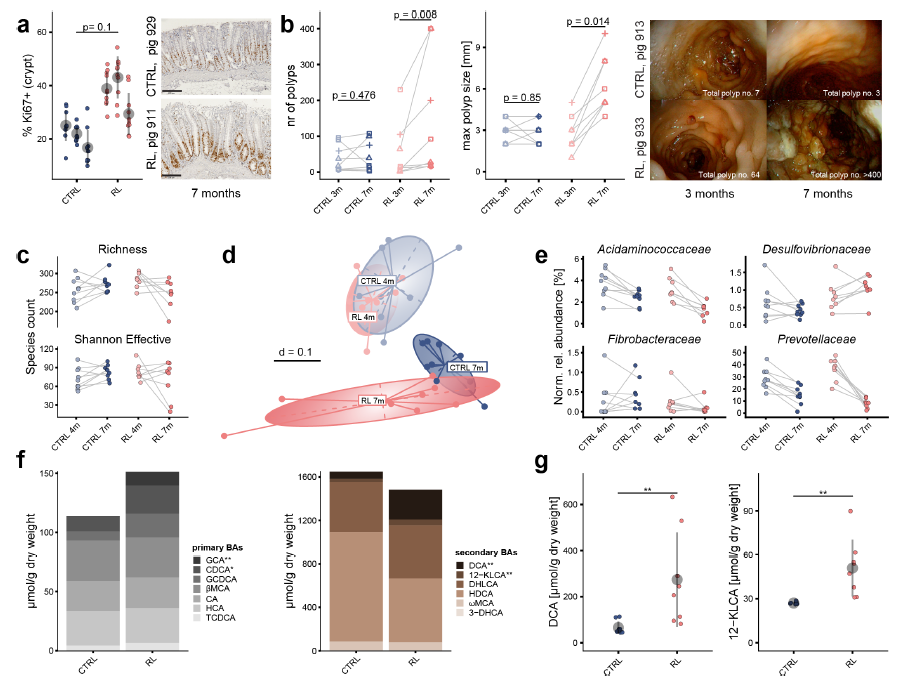
1、首先,对携带APC基因突变的转基因猪模型进行为期3个月的饮食干预。结果显示,高红肉与猪油饮食显著增加结肠息肉数量和大小,伴随上皮细胞增殖加剧,粪便中DCA等次级胆汁酸水平也明显升高。在此基础上,使用胆汁酸螯合剂考来替兰(COL)处理发现,COL能有效抑制饮食诱导的上皮细胞增殖,减少进展性息肉比例,并促进胆汁酸随粪便排出,说明通过阻断胆汁酸吸收可缓解西方饮食的促瘤作用,初步确立了胆汁酸在CRC进展中的功能角色。
2、进一步通过分析多个人群队列的宏基因组数据,鉴定出与CRC密切相关的特定7αDH+细菌。宏基因组操作分类单元(mOTU)分析表明,Clostridium scindens和C. hylomona的bai基因簇在CRC患者粪便中富集。随后在定植简化菌群(BACOMI)的无菌小鼠模型中证实,引入C. scindens可诱导DCA生成,激活结肠上皮中与增殖、分化相关的信号通路,并显著增加Ki67+细胞数量,说明特定菌株可通过产生DCA直接驱动上皮增殖。
3、为在体内验证7αDH+菌对肿瘤形成的直接影响,在化学诱导和遗传诱导的小鼠CRC模型中进行实验。结果显示,定植C. scindens或E. muris的小鼠结肠中DCA水平升高,肿瘤数量(尤其小型肿瘤)显著增加。而使用7αDH活性缺失的F. contorta突变菌株则无法诱导DCA产生或增加肿瘤负荷,表明细菌的7αDH活性是结肠肿瘤发生的关键驱动因素。
4、最后,利用人结肠类器官模型在体外验证DCA的直接促增殖作用。类器官暴露于野生型F. contorta(含DCA)的培养上清后,Ki67+细胞比例显著上升,而突变菌株上清无此效应,说明细菌来源的DCA可直接促进人结肠上皮细胞增殖,为其促瘤机制提供了直接证据。
参考文献:Osswald A, Wortmann E, Wylensek D, et al. Secondary bile acid production by gut bacteria promotes Western diet-associated colorectal cancer. Gut. 2025
#5
Nature Comunications | 化疗诱导的肠道菌群失调与吲哚-3-丙酸重塑骨髓造血,促进抗转移状态

结直肠癌术后化疗虽有获益,但30-50%患者仍出现肝转移。临床数据显示,围手术期抗生素使用会缩短无病生存期,暗示肠道菌群可能左右化疗的远期效果,但化疗所致肠黏膜炎如何经菌群调控转移,其机制尚不清楚。基于此本研究聚焦FOLFOX方案(氟尿嘧啶+奥沙利铂),提出"化疗记忆"假说:肠黏膜损伤通过长期改变菌群代谢,系统性重塑免疫微环境以抑制转移。团队利用小鼠模型、多组学及临床样本,旨在阐明菌群-代谢-免疫轴在化疗防转移中的作用,为临床合理用药和开发新型佐剂提供理论支撑。
1、16S rRNA扩增子测序+PICRUSt2:FO化疗后Firmicutes门及Clostridia纲扩张,色氨酸代谢通路显著富集;门静脉血IPA(吲哚丙酸)升高>10倍且持续10天以上,抗生素清除菌群后IPA升高消失,证实IPA来源于化疗诱导的菌群失调。
2、LC-MS代谢组:非靶向代谢组检出95种上调代谢物中IPA最显著;靶向定量显示FO组IPA超对照组10倍;临床队列(n=14)中64%CRC患者化疗后IPA升高,且与单核细胞计数显著负相关(r=-0.59,P=0.002)。
3、流式细胞术+CyTOF成像:IPA使Ly6Chigh CCR2+免疫抑制性单核细胞减少40-50%,MHCII+髓系细胞增加;Th1(T-bet+IFN-γ+)效应细胞比例上升,Treg显著减少;CD8+T细胞与Th1空间共定位增强,与Treg相互作用消失。
4、骨髓造血功能研究(CFU+RNA-seq+SCENIC)发现:IPA直接抑制骨髓CFU形成,促使共同髓系祖细胞(CMP)向巨噬细胞分化而非Ly6Chigh单核细胞;激活Rbpj/Irf8/Mafb巨噬细胞分化网络,抑制未成熟髓系特征基因(Ms4a3等)。
5、功能验证与临床转化:CD4+T细胞耗竭完全消除IPA的抗转移效应;IPA联合化疗显著降低肿瘤负荷(P<0.0001);高单核细胞(>0.8 G/L)预示CRC患者较差总生存期(P<0.0001),提示IPA可作为化疗佐剂通过重编程髓系造血增强抗肿瘤免疫。
参考文献:Bersier, L., Lorenzo-Martin, L. F., Chiang, Y.-H., et al. Chemotherapy-driven intestinal dysbiosis and indole-3-propionic acid rewire myelopoiesis to promote a metastasis-refractory state. Nature Communications. 2025
#6
Nature Comunications | 肠道微生物组预测糖尿病前期个体对膳食纤维干预的个性化反应

全球约7.2亿糖尿病前期人群,65%将进展为2型糖尿病,但现有空腹血糖、HbA1c等诊断标准无法反映胰岛素抵抗与β细胞功能的异质性,导致干预效果差异大。膳食纤维被证实可通过肠道菌群发酵产生短链脂肪酸,提升GLP-1、改善胰岛素分泌,然而不同个体对高纤维饮食的血糖反应不一,菌群特征可能是关键决定因素。既往研究样本小、缺乏随机对照证据,难以建立临床可用的菌群预测模型。为此,作者开展多中心随机开放标签试验,纳入802例糖尿病前期受试者,先以年龄、BMI、HbA1c、HOMA2-IR与HOMA2-B等多维指标重新聚类为4个代谢亚群,再随机给予膳食纤维补充或常规教育干预6个月,旨在明确菌群基线特征是否决定纤维干预的血糖获益,并构建可推广的个性化预测模型,为糖尿病精准预防提供依据。
1、16S rRNA扩增子测序:将802例样本划分为4个代谢亚群,Cluster-3/4的菌群结构、α-多样性及共丰度网络与Cluster-1/2显著不同;鉴定49个差异 ASV,获益组(Cluster-3/4)干预后Guild-2(产丁酸/乙酸)/Guild-1(耐药)比值升高,Parabacteroides distasonis等9个纤维响应菌显著富集。
2、PICRUSt2功能预测:发现Guild-2富集碳水化合物利用及SCFA生成基因;Guild-1富集药物耐药与细菌毒力基因,证实两派菌群功能对立。
3、血清非靶向LC-MS代谢组:Cluster-3/4干预后49–61种代谢物显著改变,芳香族及支链氨基酸代谢通路下调,与菌群SCFA产生同步增强。
4、LightGBM机器学习+SHAP 解释:以基线44个ASV建立预测模型,ROC-AUC达0.81;计算微生物-纤维评分(MFS),cut-off以17/25为截点 在训练集与两个独立验证队列均以99–100%准确率区分高/低响应者。
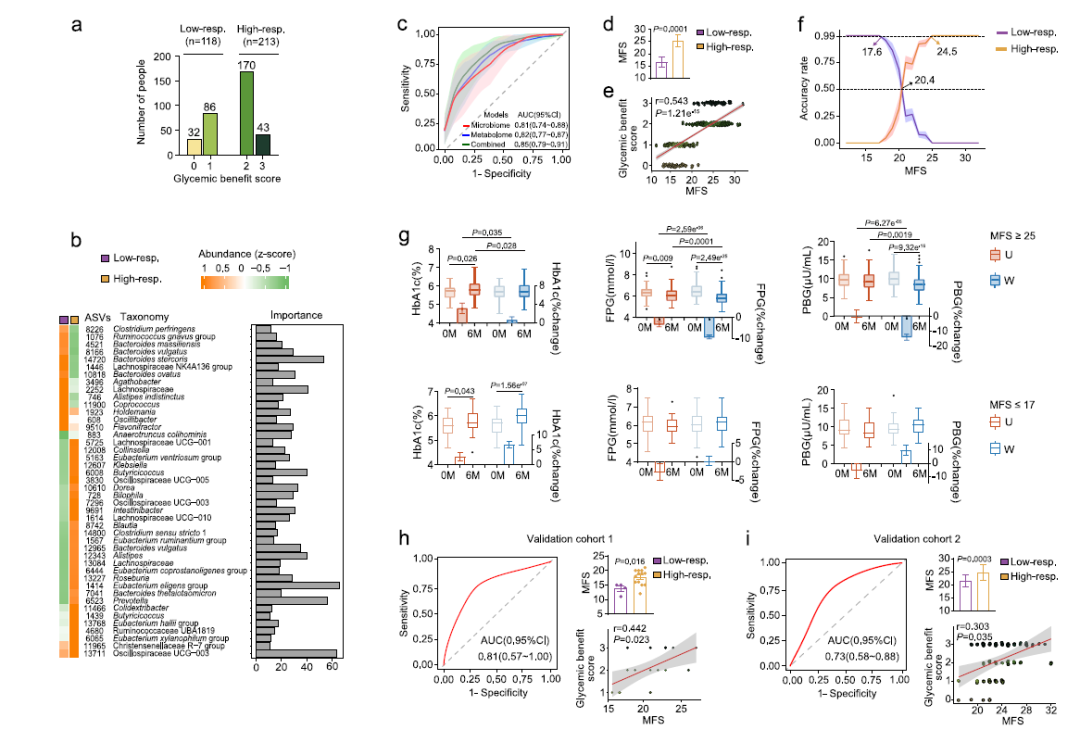
参考文献:Song, D., Feng, G., Ma, Y., et al. Gut microbiome predicts personalized responses to dietary fiber in prediabetes: A randomized, open-label trial. Nature Communications. 2025
#7
Cell Host & Microbe | 肠道微生物氨基酸代谢通过调控CD8⁺T细胞功能影响癌症进展及抗肿瘤免疫力

肠道菌群与癌症进展及免疫治疗效果密切相关,但具体机制尚不明确。结直肠癌患者的肠道微生物氨基酸代谢与健康人群存在显著差异,肠道微生物对肠道氨基酸的消耗会影响宿主氨基酸稳态,进而可能调控癌症发生发展。本研究旨在探究肠道微生物中调控氨基酸水平的通路对结直肠癌进展的影响,明确关键微生物基因、膳食氨基酸与抗肿瘤免疫之间的关联,为癌症治疗提供新的靶点。
1、动物模型构建与饮食干预:高氨基酸饮食在无菌(GF)小鼠中显著促进肿瘤生长,但在特定病原体(SPF)小鼠中该效应被削弱。
2、人粪便微生物移植给抗生素处理小鼠:16S rRNA测序分析发现,被移植氨基酸高消耗效率微生物的小鼠,血清和粪便氨基酸水平更低,肿瘤负担显著高于低消耗效率组。
3、bo-ansB基因的功能验证与机制探究:拟杆菌属的bo-ansB基因核心功能是编码天冬酰胺酶,可消耗肠道及肿瘤微环境中的天冬酰胺(Asn),导致肿瘤浸润CD8⁺T细胞的干细胞样特性和效应功能受损,肿瘤进展加快。
4、结直肠癌模型与人类队列分析:结果显示,Δbo-ansB(敲除bo-ansB基因)定植的结肠癌小鼠肿瘤负担减轻、CD8+T细胞功能增强。人类中ansB、argD等微生物氨基酸消耗基因丰度与结直肠癌进展相关,ansB丰度与粪便Asn水平呈负相关。
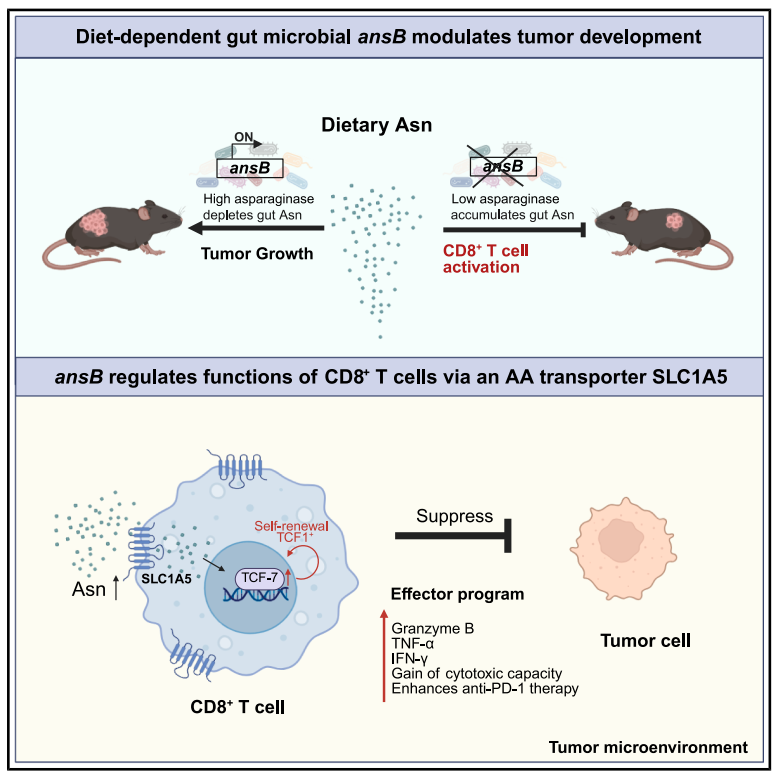
参考文献:Qiao S, et al. Microbiota utilization of intestinal amino acids modulates cancer progression and anticancer immunity. Cell Host Microbe. 2026
#8
Advanced Science | 结直肠癌细胞的武器:RNF32与SPP1+巨噬细胞结合以促进肝脏转移,以吲哚-3-乙酸为靶点

结直肠癌(CRC)是全球高发癌症,肝转移是其主要致死原因,50%-60%的患者会发生转移,且近80%为不可切除肝转移,预后极差。基因治疗虽具潜力,但受靶点筛选等问题限制,临床转化受阻。RNF32作为RING指蛋白家族的E3泛素连接酶,已被发现与部分肿瘤进展相关,可能促进结直肠癌增殖和巨噬细胞极化,但它在CRC肝转移中的具体功能、分子机制及靶向药物仍不明确。
1、基因筛选与验证:结合多数据库验证,确定RNF32为结直肠癌肝转移关键驱动基因,其高表达与患者不良预后相关。
2、体内外功能验证:RNF32可促进结直肠癌细胞增殖、上皮-间质转化(EMT)及体内肿瘤生长和肝转移。
3、分子机制探究:采用RNA测序、蛋白相互作用实验、泛素化实验等,发现RNF32通过△2结构域结合GSK3β的D3结构域,催化其K60位点K48连接泛素化降解,激活Wnt/β-连环蛋白通路驱动EMT。
4、肿瘤微环境调控:经质谱流式、巨噬细胞耗竭、条件培养基共培养等实验,揭示RNF32通过Wnt通路上调CCL2,激活巨噬细胞CCR2/FABP1/PPARG轴诱导SPP1表达,SPP1+巨噬细胞与肿瘤细胞CD44结合增强干细胞特性,重塑免疫抑制微环境。
5、药物筛选与验证:通过虚拟筛选、分子对接及微量热泳动(MST)验证,发现吲哚-3-乙酸(IAA)为RNF32高亲和力抑制剂;体内外实验证实IAA可抑制结直肠癌细胞增殖、肿瘤生长及肝转移,逆转免疫抑制,且生物安全性良好。
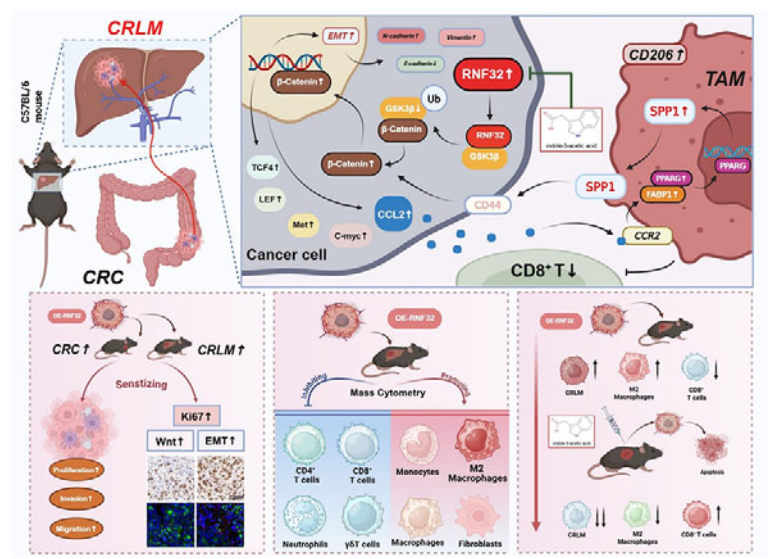
参考文献:Wang H, et al. Colorectal Cancer Cell's Weapon: RNF32 Engages SPP1+ Macrophages to Foster Liver Metastasis, Targeted by Indole-3-Acetic Acid. Adv Sci (Weinh). 2025
